金屬的耐腐蝕性
什麼是耐腐蝕?
金屬抵抗腐蝕的能力稱為耐蝕性。這種能力是由特定條件下的腐蝕速率決定的。定量和定性特徵用於評估腐蝕程度。

質量特徵是:
-
改變金屬表面的外觀;
-
金屬微觀結構的變化。
數量特徵是:
-
第一個腐蝕焦點出現之前的時間;
-
在一定時間內形成的腐蝕灶數量;
-
單位時間金屬減薄;
-
單位時間內單位面積金屬質量的變化;
-
單位時間單位表面在腐蝕過程中吸收或釋放的氣體體積;
-
給定腐蝕速率下的電流密度;
-
一段時間內屬性的變化(機械屬性、反射率、電阻)。
不同的金屬具有不同的耐腐蝕性。為了提高耐腐蝕性,採用特殊方法:鋼合金化、鍍鉻、鍍鋁、鍍鎳、噴漆、鍍鋅、鈍化等。
鐵和鋼

在氧氣和純水存在下,鐵迅速腐蝕,反應按以下公式進行:
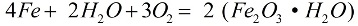
在腐蝕過程中,一層鬆散的銹層覆蓋在金屬上,這層銹層根本不能保護它免受進一步破壞,腐蝕會一直持續到金屬完全被破壞。更活躍的鐵腐蝕是由鹽溶液引起的:即使空氣中存在少量氯化銨 (NH4Cl),腐蝕過程也會進行得更快。在鹽酸(HCl)的稀溶液中,反應也會積極進行。
濃度超過 50% 的硝酸 (HNO3) 會導致金屬鈍化——它會被一層保護層覆蓋,儘管它很脆弱。汽化硝酸對鐵是安全的。
濃度超過 70% 的硫酸 (H2SO4) 會使鐵鈍化,如果 St3 級鋼在 40°C 的溫度下儲存在 90% 的硫酸中,那麼在這些條件下,腐蝕速率不會超過每年 140 微米。如果溫度為 90°C,則腐蝕將以 10 倍的速度繼續進行。鐵濃度為50%的硫酸會溶解。
磷酸(H3PO4)不會腐蝕鐵,鹼性溶液、氨水、乾燥的Br2和Cl2等無水有機溶劑也不會。
如果將千分之一的鉻酸鈉加到水中,它會像六偏磷酸鈉一樣成為一種極好的鐵腐蝕抑製劑。但氯離子 (Cl-) 會去除鐵的保護膜並增加腐蝕。鐵是技術純的,含有約 0.16% 的雜質,並且具有很高的耐腐蝕性。
中合金鋼和低合金鋼
在低合金鋼和中合金鋼中添加鉻、鎳或銅合金可提高其耐水和大氣腐蝕能力。鉻越多,鋼的抗氧化性越高。但如果鉻含量低於12%,那麼化學活性介質就會對這種鋼材產生破壞作用。
高合金鋼
在高合金鋼中,合金成分在10%以上。如果鋼中含有 12% 到 18% 的鉻,那麼這種鋼可以承受幾乎所有的有機酸、食物、硝酸 (HNO3)、鹼和許多鹽溶液的接觸。在 25% 的甲酸 (CH2O2) 中,高合金鋼將以每年約 2 毫米的速度腐蝕。但是,強還原劑、鹽酸、氯化物和鹵素會破壞高合金鋼。
鎳含量為 8% 至 11% 和鉻含量為 17% 至 19% 的不銹鋼比單獨使用高鉻鋼更耐腐蝕。此類鋼可耐受酸性氧化介質,例如鉻酸或硝酸,以及強鹼。
鎳作為添加劑將提高鋼對非氧化環境和大氣因素的抵抗力。但環境是酸性的、還原性的、帶有鹵素離子的酸性——它們會破壞鈍化氧化層,結果使鋼材失去耐酸能力。
添加1%~4%鉬的不銹鋼比鉻鎳鋼具有更高的耐蝕性。鉬可以抵抗硫酸和硫酸、有機酸、海水和鹵化物。
矽鐵(添加 13 至 17% 矽的鐵),即所謂的鐵矽鑄件,由於存在 SiO2 氧化膜而具有耐腐蝕性,硫酸、硝酸或鉻酸都不能破壞它,他們只是加強了這層保護膜。但是鹽酸(HCl)很容易腐蝕矽鐵。
鎳合金和純鎳

鎳可以抵抗許多因素,包括大氣和實驗室、清潔水和鹽水、鹼性和中性鹽,例如碳酸鹽、醋酸鹽、氯化物、硝酸鹽和硫酸鹽。非含氧和非熱有機酸以及濃度高達 60% 的沸騰濃鹼性氫氧化鉀 (KOH) 不會損害鎳。
腐蝕是由還原性和氧化性介質、氧化性鹼性或酸性鹽、氧化性酸(例如氮氣、潮濕氣態鹵素、氮氧化物和二氧化硫)引起的。
蒙乃爾金屬(鎳含量高達 67%,銅含量高達 38%)比純鎳更耐酸,但不能承受強氧化性酸的作用。它的不同之處在於對有機酸和大量鹽溶液具有相當高的抵抗力。大氣和水腐蝕不會威脅蒙乃爾金屬;氟化物對他來說也是安全的。蒙乃爾金屬可以像鉑金一樣安全地承受 40% 的沸騰氟化氫 (HF)。
鋁合金和純鋁

鋁的保護性氧化膜使其能夠抵抗常見的氧化劑、乙酸、氟、大氣以及大量的有機液體。雜質含量低於 0.5% 的工業純鋁非常耐過氧化氫 (H2O2) 的作用。
它在強還原環境中被苛性鹼的作用破壞。稀硫酸和發煙硫酸對鋁來說並不可怕,但中等強度的硫酸會破壞它,熱硝酸也是如此。
鹽酸會破壞鋁的保護性氧化膜。鋁與汞或汞鹽接觸對前者俱有破壞性。
純鋁比硬鋁合金(其中銅含量高達 5.5%、鎂含量高達 0.5% 和錳含量高達 1%)等更耐腐蝕,而後者的抗腐蝕性較差。 Silumin(添加 11 到 14% 的矽)在這方面更穩定。
銅合金和純銅

純銅及其合金在鹽水或空氣中不腐蝕。銅不怕腐蝕:稀鹼、乾燥 NH3、中性鹽、乾燥氣體和大多數有機溶劑。
含有大量銅的合金,例如青銅,可以承受酸,甚至是冷濃硫酸或熱稀硫酸,或室溫(25°C)下的濃鹽酸或稀鹽酸。
在沒有氧氣的情況下,銅與有機酸接觸不會腐蝕。氟和乾燥的氟化氫對銅都沒有破壞作用。
但銅合金和純銅如果存在氧氣,以及與濕 NH3、某些酸鹽、乙炔、CO2、Cl2、SO2 等濕氣體接觸,會被各種酸腐蝕。銅很容易與汞相互作用。黃銅(鋅和銅)的耐腐蝕性不強。
在此處查看更多詳細信息- 電氣工程中的銅和鋁
純鋅

乾淨的水,就像乾淨的空氣一樣,不會腐蝕鋅。但如果水中或空氣中有鹽類、二氧化碳或氨氣,鋅就會開始腐蝕。鋅溶解在鹼中,尤其是在硝酸 (HNO3) 中溶解得更快,在鹽酸和硫酸中溶解得更慢。
有機溶劑和石油產品一般對鋅沒有腐蝕作用,但如果接觸時間過長,如與裂化汽油接觸,汽油在空氣中氧化,酸度增加,開始腐蝕鋅。
純鉛

鉛對水和大氣腐蝕的高抵抗力是眾所周知的事實。它不會腐蝕 我帶領 當在土壤中時。但是,如果水中含有大量二氧化碳,那麼鉛就會溶解在其中,因為會形成碳酸氫鉛,而碳酸氫鉛已經是可溶的。
一般來說,鉛對中性溶液有很強的抵抗力,對鹼性溶液有一定的抵抗力,對某些酸也有抵抗力:硫酸、磷酸、鉻酸和硫酸。用濃硫酸(98%以上)在25℃的溫度下,鉛能慢慢溶解。
濃度為 48% 的氟化氫在加熱時會溶解鉛。鉛與鹽酸和硝酸、甲酸和乙酸發生強烈反應。硫酸會在鉛上覆蓋一層微溶的氯化鉛 (PbCl2),並且不會進一步溶解。在濃硝酸中,鉛也會鍍上一層鹽,但稀硝酸會溶解鉛。氯化物、碳酸鹽和硫酸鹽對鉛沒有侵蝕性,而硝酸鹽溶液則相反。
純鈦

良好的耐腐蝕性是鈦的標誌。不被強氧化劑氧化,耐鹽溶液、FeCl3等。濃無機酸會引起腐蝕,但即使沸騰的硝酸濃度低於 65%,硫酸 - 高達 5%,鹽酸 - 高達 5% - 也不會導致鈦腐蝕。對鹼、鹼性鹽和有機酸的正常耐腐蝕性將鈦與其他金屬區分開來。
純鋯

鋯比鈦更能抵抗硫酸和鹽酸,但對王水和濕氯的抵抗力較差。它對大多數鹼和酸具有高耐化學性,耐過氧化氫 (H2O2)。
某些氯化物、沸騰濃鹽酸、王水(濃硝酸 HNO3 (65-68 wt.%) 和鹽水 HCl (32-35 wt.%) 的混合物、熱濃硫酸和發煙硝酸的作用關於腐蝕,這是鋯的一種疏水性特性,即這種金屬不會被水或水溶液潤濕。
純鉭

鉭的優異耐化學性與玻璃相似。其緻密的氧化膜可在高達 150°C 的溫度下保護金屬免受氯、溴、碘的作用。大多數酸在正常條件下對鉭不起作用,即使是王水和濃硝酸也不會引起腐蝕。鹼溶液對鉭幾乎沒有影響,但氟化氫對其有作用,使用濃熱鹼溶液,鹼熔體用於溶解鉭。
