法拉第電解定律
法拉第電解定律是基於邁克爾·法拉第 (Michael Faraday) 於 1836 年發表的電化學研究的定量關係。
這些定律決定了物質釋放量之間的關係 電解過程中 以及通過電解液的電量。法拉第定律有兩個。在科學文獻和教科書中,這些定律有不同的表述。
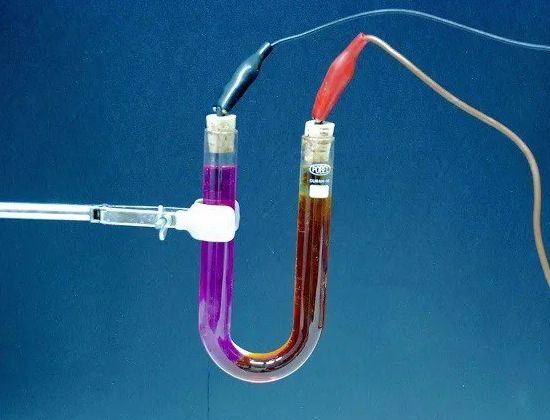
電解 — 在通過過程中從電解質中釋放出其組成物質 電……例如,當電流通過微酸化的水時,水會分解成它的組成部分——氣體(氧氣和氫氣)。
從電解液中釋放出的物質的量與通過電解液的電量成正比,即電流強度乘以該電流流過的時間的乘積。因此,電解現象可以用來衡量電流的強弱,從而判斷 當前單位.
電解液 — 一種溶液,通常是一種傳導電流的複雜液體。在電池中,電解質是硫酸溶液(鉛溶液)或苛性鉀或燒鹼溶液(鐵鎳溶液)。在原電池中,任何化合物(氨、硫酸銅等)的溶液也可用作電解質。
邁克爾·法拉第 (1791 - 1867)
邁克爾·法拉第 (1791—1867)——英國物理學家,現代電磁現象學說的奠基人。他的職業生涯始於一家裝訂車間的學徒。他只接受過初等教育,但獨立學習科學並擔任化學家德維的實驗室助理,他成為了一位偉大的科學家,最偉大的實驗物理學家之一。
法拉第開了 電磁感應現象,電解定律,發展了電場和磁場學說並奠定了基礎 現代電磁場概念的基礎……他是第一個提出電磁現象的振動、波動性質想法的科學家。
法拉第電解第一定律
電解過程中沉澱在電極上的物質的質量與轉移到該電極(通過電解液)的電量成正比。電量是指電荷的多少,通常以挂件來衡量。
法拉第電解第二定律
對於給定量的電量(電荷),電解過程中沉積在電極上的化學元素的質量與該元素的等效質量成正比。物質的當量質量是其摩爾質量除以一個整數,具體取決於該物質所參與的化學反應。
或者
相同的電量導致電解過程中電極上釋放出等量的不同物質。放出一摩爾當量的任何物質,都需要消耗等量的電量,即96485℃。這個電化學常數稱為 法拉第數.
法拉第定律的數學形式
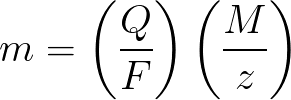
-
m 是沉積在電極上的物質的質量;
-
Q 是在電解過程中通過的吊墜中的總電荷值;
-
F = 96485.33 (83) C/mol — 法拉第數;
-
M 是元素的摩爾質量,單位為 g/mol;
-
z——物質離子的價數(每個離子的電子數);
-
M/z——施加在電極上的物質的當量質量。
應用到法拉第電解第一定律,M、F、z都是常數,所以Q越大,m就越大。
根據法拉第電解第二定律,Q、F、z是常數,所以M/z越大,m也越大。
對於直流電,我們有
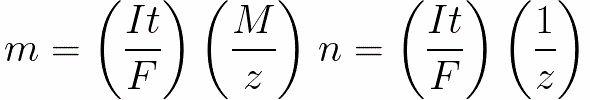
-
n是釋放在電極上的摩爾數(物質的量):n=m/M。
-
t是直流電流通過電解質的時間。對於交流電,總電荷會隨時間累加。
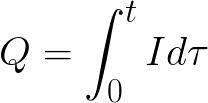
-
t 是總電解時間。
應用法拉第定律的示例
需要寫出惰性陽極電解硫酸鈉水溶液時陰極和陽極的電化學過程方程式。問題的解決方案如下。在溶液中,硫酸鈉將根據以下方案解離:
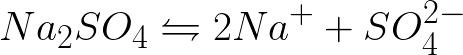
該體系中的標準電極電位如下:
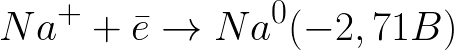
這比中性介質中的氫電極 (-0.41 V) 負得多。因此,在負電極(陰極)上,水的電化學解離將根據以下方案開始釋放氫和氫氧根離子:
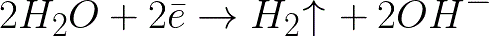
並且接近帶負電的陰極的帶正電的鈉離子將在陰極附近,在溶液的相鄰部分中聚集。
根據以下方案,水會在正極(陽極)發生電化學氧化,從而導致氧氣的釋放:
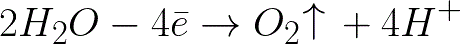
在此系統中,標準電極電位為 +1.23 V,遠低於以下系統中的標準電極電位:
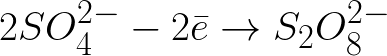
向帶正電的陽極移動的帶負電的硫酸根離子將聚集在陽極附近的空間中。

